
发布日期: 2024-10-23 22:16:42 来源:贝博官方入口-试剂盒
随着我国艾滋病检测工作的持续发展和艾滋病检测服务可及性 的逐步扩大,艾滋病检测实验室数目逐年增长,检验测试能力不断下沉。承担艾滋病检测工作的实验室已遍及等各个系统。 检测实验室的全面质量控制对获得客观、公正、科学的检测结果很重要, 检验测试质量水平的高低,反映了实验室的综合实力。

近日,为进一步规范和提升我国艾滋病检测实验室的工作质量,保证艾滋病检测结果的准确性和可靠性,中国疾病预防控制中心性病艾滋病预防控制中心组织专家编写了《全国艾滋病检测实验室质 量控制指南》,从实验室质量管理和生物安全管理、室内质量控制和室间质量评价三个层面,为艾滋病检测实验室所开展检验测试的项目的质量 控制策略和质量控制措施进行了系统全面的技术指导。
HIV抗体和抗原检测、CD4+T淋巴细胞计数HIV核酸检测、和HIV基因型耐药检测。
CD4+T淋巴细胞计数常用的检测的新方法是流式细胞术(Flow cytometry,FCM)和便携式CD4+ T淋巴细胞仪。
目前常用的HIV-1 RNA检测的新方法包括实时荧光定量PCR扩增技术和RNA捕获探 针等温扩增技术。
用于补充试验的抗体确证检测,以及用于区分新近感染者 和既往感染者的新近感染检测等。
感染者免疫状况、判断疾病进程、评价抗病毒药物治疗效果和估测预后提供了重要指标。
耐药突变的产生和发展会影响抗病毒治疗的疗效。因此,及时进行耐药 检测在艾滋病预防与治疗中具备极其重大作用。
HIV抗体确证检测失控的因素很多,如操作失误、试剂或质控品失效、仪器设 备维护不当等原因。而对于CD4+ T 淋巴细胞计数检测质控而言,吸液不准确竟然是导致检测错误的最常见原因。在实验过程中,样本和试剂的质量、实验操作人员的技能(例如对电压值调试、荧光补偿值的确定、阈值设定、数据获取量、图形分析能力)、仪器状态及数据分析方法等多 种因素均有可能影响流式细胞检测结果。
PMT)的效率和性能。通过后再进行室内质控检测,质控通过后再进 行标本检测。每次开机和关机应做好仪器保养维护。需定时进行荧光补偿的验证和调整, 由仪器厂家工程师定时进行检测维护。
1)确定仪器性能大多数台式流式细胞仪在每次实验前应使用生产厂商建议的方法验证校准颗粒(如 标准化荧光微球),以确定仪器性能是不是满足规范。
2)“分析窗口”在“样本空间”中的定位 根据应用需要调整每个参数的荧光信号放大器增益或PMT电压设置,以便该应用 程序的常规样本出现在这些直方图通道的范围内(即“分析窗口”)。
3)设置多色标记光谱重叠的荧光补偿(“颜色补偿”) 荧光补偿是校正一种荧光染料进入滤光片的光谱重叠的过程用于监视另一个荧光 染料的窗口(见图2-3-1)。在临床上使用的大多数仪器中,这种校正是通过调整流式细 胞仪上的荧光信号补偿来完成的。经过该校正,将不应该是两种荧光抗体双阳性的细胞 群调整到相应的直角荧光象限中,使双阳象限中无荧光重叠。同时,避免过度补偿这是 至关重要的,因为过度补偿有几率会使将双阳性细胞错误地归类为单阳性细胞。该程序 可以手动执行;或者软件可以自动执行。
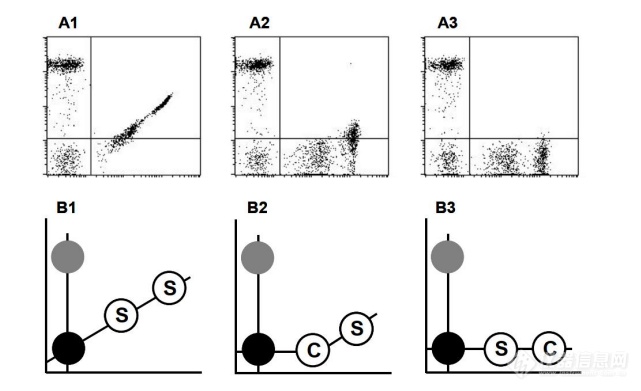
A1至A3及其各自的示意图B1至B3说明分别为未补偿、欠补偿和正确补 偿的双色显示器。这个标记为“S”的空心圆表示需要精确颜色补偿的细胞群体。标有 “C”的空心圆表示用于调整颜色补偿设置。如果补偿设置的强度没有超过所分析样本 的荧光强度,该样本将被过补偿(A2、B2)。如果补偿设置的强度超过荧光分析样本的 强度,样本不太可能被过度补偿(A3,B3)。注:在图A3和B3,未染色、补偿粒子和 染色粒子的中值荧光(y轴)单元格将大致相等。当采用两种及以上抗体组合方案进行淋巴细胞亚群分析时,或当光学检测通道的电 压及增益发生变动时,或当仪器维修保养后,都有必要进行荧光补偿调整。按照操作说明 书执行,避免过度补偿。
Levey-Jennings质控图,观察质控品检测的趋势和变化,如果 任何值超出要求的标准差范围,则应重复检测。如果问题持续存在,则调整仪器设置, 或联系相关仪器厂家工程师。
FS-SS设门检测CD3\CD4\CD8时,要求待测样本尽可能新鲜,鞘液和洗液洁净,溶血和洗涤充分。检测 时,可以适当增大前向散射光(FSC)和侧向散射光(SSC)的电压,有助于将淋巴细胞 与碎片及单核细胞明显区分开。
对淋巴细胞进行设门时,单核细胞不能超过3%,设门不能过小,应保证门内有97%以上的淋巴细胞。
可靠性分析数据符合下面情况视为有效(以质控血样为参照): 以CD45设门时,CD3+CD4+%与CD3+CD8+%总和应在CD3+%±5%范围以内; 当两管都有CD3的三色试剂检测CD3+CD4+与CD3+CD8+T淋巴细胞时,CD3的变异 性应小于等于2%;更换操作者时,用正常血液,或者质控全血进行不少于5次重复检 测,实验结果的变异系数应小于10%。
CD4+ T淋巴细胞测定过程中,同时使用室内质控品,可帮助分析和判断仪器的 准备和分析是否均处于最佳状态。稳定的全血样本可用于室内质控品,首选使用商品化 质控品,使用全血质控品时,应按照说明书操作。 质控品应和检测样本一起进行免疫荧光染色,并在样本检测前进行上机测定和数据 分析。如无法获取商品化质控品,实验室宜选择与检测值水平相近的质控品浓度,以保 证检测值的有效性。 检测当日至少做一次室内质控,并至少包括两个浓度水平,CD4+ T淋巴细胞的绝 对细胞计数应包括低值浓度水平质控。有条件的实验室宜每批检测均进行室内质控。实验室应建立每一批次质控品的靶值和可接受范围,不可直接引用说明书提供的质控范围。 更换新批号质控品前,可通过每日检测4次质控品(不同时间点),连续5天收集20次 数据,计算均值。均值作为新批次靶值,结合既往累计CV值推算SD。应至少选择13S和22S作为失控判断标准,应有相应的失控纠正措施。
吸液不准确是导致检测错误的最常见原因。核查人员是否经过周期性培训和测 评,移液器是否定期校准。
仪器设置是否按照生产厂商的要求用商业化的校准物质(如荧光微球)校准流式细胞仪并建立档案,监测仪器的性能变化。
5.4全血质控品染色后的活力验证(不使用含固定剂溶血素溶血的情况下),7-AAD(7-氨基放线菌素D)阴性者为活细胞群,7-AAD阳性者为细胞膜不完整的死细胞群。 将7-AAD阴性细胞群计数为75%时称为最低细胞活力。对于低于75%的细胞活力的标 本,使用结合CD45(评估淋巴细胞、单核细胞和粒细胞死亡)复染进行细胞活力的评 估。
流式细胞仪的携带污染率是否大于0.5%。(携带污染率:分析物被仪器由一个检测样本到下一个样本的携带量,从而错误地引起第二个被测样本分析物浓度的增加。)
流式细胞仪使用后是否根据厂家要求定时进行清洗及维护。检测环节诸多,应该要依据详细情况逐项排查。