
发布日期: 2024-10-05 12:24:43 来源:贝博BB平台app免费下载
由中国科协、卫生健康委、应急管理部和市场监管总局等部委主办,中央网信办指导,全国学会、权威媒体、社会机构和科技工作人员共同打造。
截至2020年2月5日24时,我国新冠病毒感染累计确定诊出的病例28018例,已达急性呼吸综合征(SARS)期间全球发病人数的3倍多。疫情汹涌,公众期盼科学家和医生迅速找到救命“神药”。
近日来,各种有关抗新冠病毒药物的消息不断传出,也有人连夜排队将某种药物抢购一空,到底这些疑似有效的抗新冠病毒药物靠谱吗?我们今天就来捋一捋。
众所周知,疫苗是防止疫情扩散最有效的方法之一。针对新冠病毒肺炎疫情,新疫苗研发自然很快提上日程。
1月下旬,中国疾病预防控制中心、美国国立过敏与传染病研究所、澳大利亚墨尔本大学和香港大学等多家国内外研究机构相继宣布开启抗新冠病毒疫苗研发,但是从研发时间和技术难度上,新疫苗即使研究成功,可能也难以在此次疫情中得到应用。
无论是减毒活疫苗、灭活疫苗、亚单位疫苗等传统疫苗,还是重组蛋白抗原疫苗、DNA疫苗、RNA疫苗等基因工程疫苗,与新药研发一样,疫苗研发都要经历候选疫苗筛选、临床前研究和临床研究等阶段。
临床前试验主要在小鼠、大鼠或猴子等动物身上验证疫苗的安全性和有效性,而临床试验则将重点验证候选疫苗在人体的安全性和有效性。从候选疫苗筛选到临床I期试验,大概需要1-2年,如从获得SARS冠状病毒的基因组序列到疫苗临床I期试验花费了20个月时间。
尽管美国国立过敏与传染病研究所计划与美国摩德钠(Moderna公司宣称,他们将合作研制新冠病毒的信使RNA疫苗,只需要3个月即可进入临床试验,不过由于后续临床试验还至少需要1年以上的时间,预计新疫苗的研发进度很难赶上疫情的发展。
另一个难题是针对病毒的疫苗研发难度非常大,即使动物试验证明有效,也不能够确保人体试验有效。
全球艾滋病疫苗研制历史已超过30年,进入临床试验的候选疫苗40多个,只有6个疫苗进入后期临床试验,却至今无一成功。目前全球唯一批准上市的埃博拉疫苗历经16年才研发成功。
自2003年SARS爆发以来,中国和其他几个国家的科学家一直在尝试研制SARS冠状病毒疫苗,但是只有少数进入临床I期,因为后来没有SARS患者,无法开展后续临床试验,SARS疫苗研发也陷入停滞。
全球多个机构筛选的中东呼吸综合征(MERS)候选疫苗已达40种,但是目前仅有一种针对MERS冠状病毒刺突蛋白的DNA疫苗在临床试验中表现出较好的安全性和免疫效果。可见疫苗研发并不是特别容易,很难在极短的时间研发出安全而有效的新冠病毒疫苗。
据1月31日《新英格兰医学杂志》报道,美国华盛顿州的医生采用了一种实验性新药,使得美国第一例新冠病毒肺炎严重患者的病症显著改善,用药1天后即刻见效,用药五天后,除咳嗽外,患者所有症状均得以缓解,而且没再次出现明显的不良反应。
这一结果无疑给新冠病毒感染者带来了巨大的希望。不过,一个病例的成功并不能说明该药真正具有抗新冠病毒的药效,还需要更严格的随机双盲临床试验加以验证。
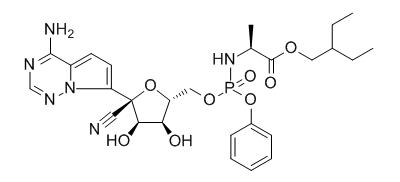
这种药物名为瑞德西韦(Remdesivir),为经过改造的核苷酸类似物,最大的作用于RNA病毒的RNA聚合酶,使其异常发挥作用,从而抑制RNA病毒的复制。
瑞德西韦由美国生物制药巨头——吉利德科学(GileadSciences)公司研发,原本大多数都用在治疗埃博拉患者。但是据2019年12月18日《新英格兰医学杂志》公布的一项临床试验报告数据显示,该临床试验招募了近700名患者,从2018年11月到2019年9月试用了瑞德西韦等四种药物,结果采用瑞德西韦的实验组死亡率高达53%,为四种实验新药最高,而另外两种药物的死亡率可降至30%左右。就这样,瑞德西韦作为抗埃博拉新药的希望宣告破灭。
不过,吉利德公司并没有将瑞德西韦吊死在埃博拉病毒这一棵树上。从两年前开始,吉利德公司的研究人员通过体外细胞试验和体内动物实验陆续发现,瑞德西韦对SARS冠状病毒、MERS冠状病毒、动物源冠状病毒及尼帕病毒等多种RNA病毒具有非常明显的抗性。
据2020年1月10日《自然通讯》杂志的一篇研究论文,小鼠试验显示,作为预防性和治疗性药物,瑞德西韦均可明显降低小鼠肺部的MERS冠状病毒载量,显著改善实验动物的肺功能和严重的肺部症状。
2020年2月4日,中国科学院武汉病毒研究所等机构的研究人员在《细胞研究》报道称,他们通过体外细胞试验发现,瑞德西韦与氯喹(抗疟疾特效药)联合使用,可显著抑制人体细胞的新冠病毒感染,建议开展临床试验进一步评价这一药物组合的疗效。
武汉病毒研究所还为这一潜在疗法申请了中国发明专利,引起一些争议,不过针对其他机构的原研药申请用途专利,是对自己创造性劳动的一种保护,符合国际惯例和中国知识产权保护相关法律规定,无可厚非。
武汉新冠病毒肺炎疫情发生后,吉利德公司迅速行动,希望能让瑞德西韦在治疗新冠病毒肺炎患者中展现积极疗效。除了在美国华盛顿州治疗首例患者之外,吉利德公司还与中国相关医疗机构密切合作,由于瑞德西韦已完成证明人体安全性的临床I和II试验(治疗埃博拉),因此计划直接开展临床III试验。
据生物世界(Bioworld)网站报道,这一临床试验将由北京中日友好医院等医院牵头,拟在武汉招募270名新冠病毒肺炎轻症和中度患者,预计将于4月27日完成。另据北京青年报报道,另一项针对新冠病毒肺炎重症患者的临床试验也同时在武汉开展。
相对于其他候选新药,瑞德西韦的抗新冠病毒活性在体外细胞试验和体内动物试验均得到证实,早期临床试验也已证明其人体安全性,不过该药对新冠病毒肺炎是否有真正疗效,还需要临床III期试验加以确认。
瑞德西韦能否在挽救新冠病毒肺炎患者生命的同时,从对抗埃博拉病毒的失败阴影中“起死回生”,很值得期待。
新疫苗研发遥遥无期,新药是否有效尚待确认,从已获准上市的药物中筛选出抗新冠病毒的候选药物,则成为众多研究机构的研究重点。
不过由于时间短,目前绝大多数只是通过体外细胞试验证实这些药物的潜在抗新冠病毒的活性,同样一定要经过严格的临床前试验和临床试验加以验证。
据中国科学院上海药物研究所网站1月25日消息,在蒋华良院士和饶子和院士带领下,中国科学院上海药物研究所和上海科技大学联合研究团队通过体外细胞试验,发现了30种可能对新冠病毒有效药物,这中间还包括12种抗艾滋病病毒药物等老药,以及虎杖、山豆根等中药材。
1月31日,上海药物研究所与武汉病毒研究所的研究团队还宣称,通过体外细胞试验发现,中成药双黄连口服液有抑制新冠病毒作用,同时强调需要临床试验进一步验证,不过通过一些新闻媒体报道后,不明真相的市民开始连夜抢购双黄连药品及同名的非药物产品,引起极大争议。
据长江日报2月4日报道,中国工程院院士、国家卫健委高级别专家组成员李兰娟院士带领团队同样通过体外细胞实验发现,抗流感病毒药物阿比朵尔在10~30微摩尔浓度下,抑制新冠病毒的效果比未经药物处理的对照组高60倍,并且显著抑制病毒对细胞的病变效应,抗艾滋病病毒药物达芦那韦在300微摩尔浓度下,能显著抑制病毒复制,与未用药物处理对照组比较,抑制效率达280倍。
除了上述常规药物筛选方法,计算机精准算法和人工智能等技术也前来助阵。2月3日,华中科技大学同济医学院和华为云等机构合作,通过超大规模计算机的精准算法,从8500多种已上市或正在开展临床试验的药物中筛选出5种候选药物,包括贝拉布韦(Beclabuvir)、沙奎那韦(Saquinavir)、比特拉韦(Bictegravir)、洛匹那韦(Lopinavir)和多替拉韦(Dolutegravir),并通过体外细胞试验初步证实这些药物对新冠病毒有较强的抑制作用。
2月4日,《柳叶刀》在线发表英国生物科学技术“独角兽”企业BenevolentAI公司与伦敦帝国学院的研究人员合作论文,他们基于深度学习的人工智能模型,预测抗艾滋病病毒药物巴瑞替尼(Baricitinib)能有效抑制新冠病毒的关键酶活性,阻止病毒进入细胞。
来自韩国Deargen公司与美国埃默里大学的研究人员在bioRxiv网站上发布预印本论文,他们也建立了基于深度学习的药物-靶标相互作用人工智能模型,通过评估药物和新冠病毒蛋白质之间的亲和力,预测抗艾滋病病毒药物阿扎那韦(atazanavir)对新冠病毒具有较高的抑制活性。
不过,上述候选药物均只是通过体外细胞试验或计算机辅助技术初步测试或预测其抗新冠病毒活性。正常的情况下,其抗新冠病毒的安全性和有效性还需要临床前试验和临床试验加以验证,但在疫情发生的紧急状况下,经相关主管部门批准,可直接用这些候选药物进行临床试验。
值得关注的是,据2月2日泰国公共卫生部网站消息,该国医生用抗流感病毒药奥司他韦及抗艾滋病病毒药洛匹那韦/利托那韦治疗一名新冠病毒患者,用药48小时后,患者病情好转,新冠病毒检测结果为阴性,不过在利用这一疗法治疗另一名患者时,该患者出现过敏反应,因此这一疗法是否安全和有效,需要开展更多临床研究。
国家卫生健康委员会办公厅和国家中医药管理局办公室在2月3日联合印发的《新冠病毒感染的肺炎诊疗方案(试行第五版)》中强调,目前没有确认有效的抗病毒治疗方法,抗病毒治疗可试用α-干扰素雾化吸入、洛匹那韦/利托那韦口服,或可加用利巴韦林静脉注射。虽然该诊疗方案列出了多种中成药和中药方剂,但是均未注明这些药物或方剂的抗病毒疗效。
虽然新疫苗、新药研发难度大、周期长,已上市药物也要进一步验证,但是针对新冠病毒的疫苗和药物研发步伐不能停止,这样才可以做好技术储备和产品储备,即使无法在这次疫情中发挥作用,也可能有助于应对下一次未知疫情。